Термична стабилност на протеинови солитони
- Детайли
- Категория: Новини
- Публикувана на Четвъртък, 03 Февруари 2022 22:00
- Написана от Danko Georgiev
- Посещения: 622
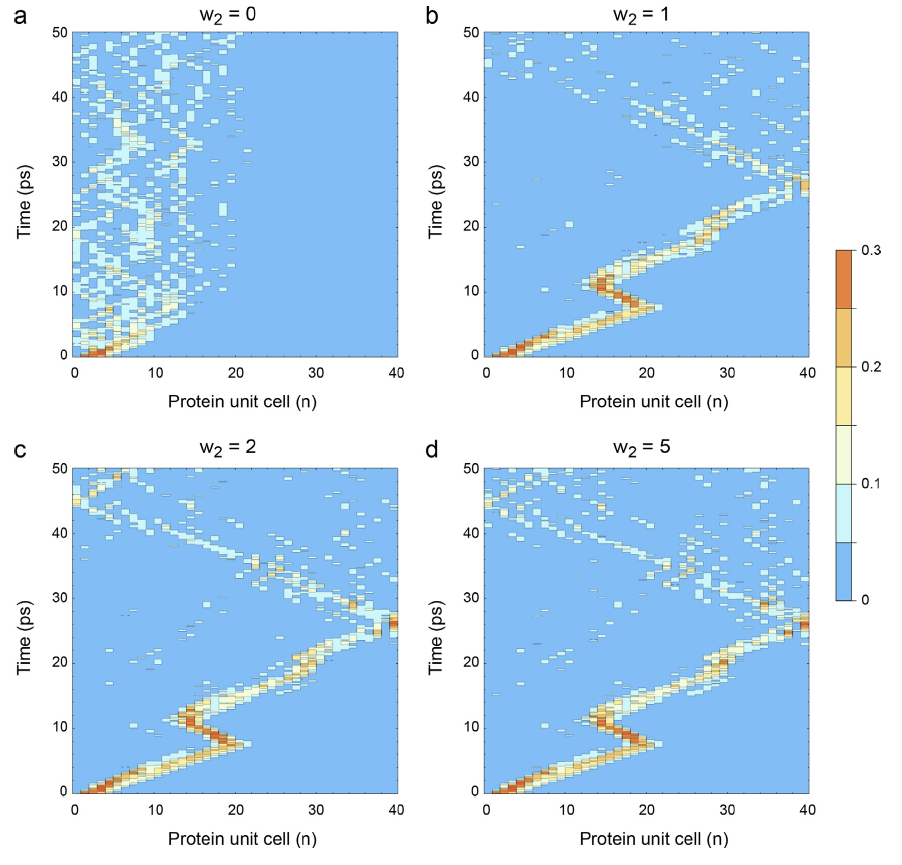
Протеиновите α-спирали осигуряват подредена среда, благоприятна за енергиен транспорт. Нелинейното взаимодействие между амид I екситони и фонони води до самозахващане на амид I енергията, генерирайки стабилни солитони при нулева температура. Наличието на термичен шум обаче може да дестабилизира солитона и да разпръсне енергията му. За да оценим термичната стабилност на солитона, ние решихме компютърно системата от стохастични диференциални уравнения, които управляват квантовата динамика на протеиновите солитони при физиологична температура.
В новата ни статия, публикувана в Chaos, Solitons and Fractals, симулирахме стохастичната квантова динамика на протеиновите солитони и демонстрирахме, че въпреки че топлинният шум е вреден за единична изолирана верига от водородно-свързани пептидни групи в α-спиралата, съвместното действие на три амид I екситонни кванта в пълната протеинова α-спирала осигурява живот на солитона от над 30 пикосекунди, по време на който амид I енергията може да се транспортира по цялата дължина на α-спирала с дължина 18 нанометра. По този начин, макромолекулните протеинови комплекси, които са изградени от протеинови α-спирали, могат да използват енергиен транспорт осъществен чрез солитони при физиологична температура. Тъй като хидролизата на една молекула на аденозин трифосфат е в състояние да възбуди три амид I екситонни кванта, е възможно многоквантални протеинови солитони да изпълняват различни специализирани физиологични функции в живите системи.